异亮氨酸(Ile)具有两个手性中心,存在4种立体异构体:(2S, 3S)l -异亮氨酸(l -Ile)、(2R, 3R)d -异亮氨酸(d -Ile)、(2S, 3R)l -别异亮氨酸(L-allo-Ile)和(2R, 3S)d -别异亮氨酸(d -allo-Ile)。L-allo-Ile在自然界不同生物体中广泛存在,包括微生物天然产物,植物和人体血浆中。在健康人群的血浆中,l-allo-Ile处于几乎被检测不到的浓度水平;但在患有罕见的常染色体隐性遗传病——枫糖尿症(maple syrup urine disease)患者的血浆和尿液中,l-allo-Ile却因为患者的对异亮氨酸和其它支链氨基酸的代谢缺陷而得到累积,浓度达到5 μM以上,因此,l-allo-Ile在血浆中的浓度水平已经作为诊断枫糖尿症的重要指标之一。但l -别异亮氨酸自50多年前被发现以来,其生物合成机制尚不清楚。
最近,中国科学院南海海洋研究所的鞠建华研究员领导的研究团队首次对天然产物中l-allo-Ile结构单元的生物合成机制进行了阐明。Desotamides和marformycins是鞠建华研究员团队从来源于我国南海深海的链霉菌发酵液中分离到的抗感染环肽类抗生素,化学结构中均含有l-allo-Ile结构单元。他们通过生物信息学分析方法,在desotamide和marformycin的生物合成途径中分别鉴定了一对由磷酸吡哆醛(pyridoxal 5’-phospahte, PLP)依赖的“氨基转移酶”和新颖异构酶(isomerase)组成的酶对DsaD/DsaE和MfnO/MfnH。通过体内基因敲除实验证实了DsaD/DsaE和MfnO/MfnH参与l-allo-Ile结构单元的生物合成,氨基转移酶DsaD/MfnO的敲除使desotamides和marformycins的产量明显降低,异构酶DsaE/MfnH的敲除使突变菌株完全丧失生产含l-allo-Ile结构单元的desotamide和marformycin组分的能力。他们在大肠杆菌中对DsaD/DsaE和MfnO/MfnH分别进行了表达和纯化,发现纯化的“氨基转移酶”DsaD/MfnO蛋白溶液呈黄色,紫外扫描提示DsaD/MfnO通过希夫碱的形式与辅因子PLP共价相连。体外生化实验证明,DsaD/DsaE和MfnO/MfnH在不需要添加额外辅因子的条件下可以协作催化l-Ile和l-allo-Ile间的可逆转化,可逆反应平衡常数为1.37。体外蛋白定点突变实验证明,氨基转移酶DsaD和MfnO的催化位点分别是其第198位和第206位赖氨酸残基,异构酶DsaE和MfnH的关键催化位点分别是位于其C-端的第115位和第107位精氨酸残基。
基于体外生化和蛋白定点突变实验结果,他们提出了DsaD/DsaE或MfnO/MfnH的可逆协作催化机理:底物l-Ile首先替换“氨基转移酶”MfnO(或DsaD)与PLP通过希夫碱的形式形成PLP-l-Ile复合物;“氨基转移酶”MfnO的Lys206(或DsaD的Lys198)对PLP-l-Ile复合物中l-Ile的a碳位去质子化,形成醌式中间体复合物;异构酶MfnH的Arg107(或DsaE的Arg115)先对醌式中间体复合物的b碳位进行去质子化,形成烯胺中间体复合物,接着再对烯胺中间体复合物的b碳位进行重新质子化,完成b碳位立体构象的改变;MfnO的Lys206(或DsaD的Lys198)对a碳位重新进行质子化,获得产物l-allo-Ile;当以l-allo-Ile作为底物时,以上机理可逆向进行。
鞠建华研究员团队认为,微生物天然产物中l-allo-Ile结构单元生物合成机制的阐明,为研究其它生物体中l-allo-Ile的来源和生物医疗提供了思路;“氨基转移酶”和异构酶组成的酶对还可以作为遗传标记,指导发现(通过基因挖掘手段)自然界中含l-allo-Ile结构单元的新颖天然产物用于药物开发。
这一研究结果发表于J. Am. Chem. Soc., 2016, 138 (1), 408-415; 李青连博士为论文的第一作者,该论文被同期JACS Spotlights (2016, 138, 461) 作为研究亮点评述。该成果得到了国家自然科学基金和“863”计划项目的资助。
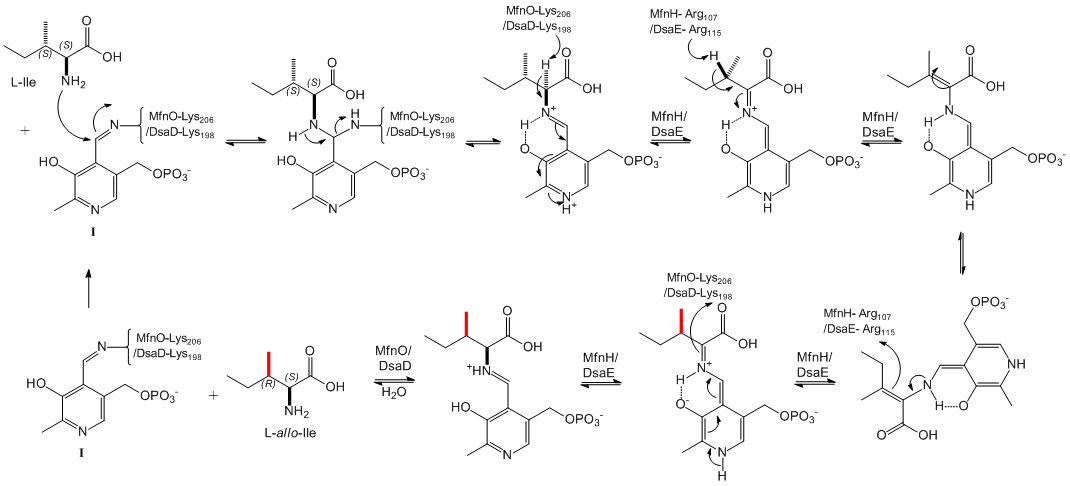
L-别异亮氨酸的生物合成机制
