
王晓雪研究团队在原噬菌体切离介导的细菌适冷新机制研究方面获得新突破
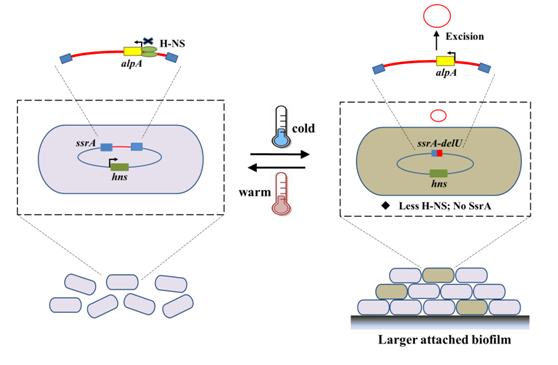
王晓雪研究员领导的团队在环境微生物生态学权威杂志《The ISME Journal》发表论文“Cold adaptation regulated by cryptic prophage excision in Shewanella oneidensis(2016, doi: 10.1038/ismej.2016.85)”(第一作者曾振顺、通讯作者王晓雪),首次发现Shewanella oneidensis的基因组中存在新的原噬菌体CP4So,证实原噬菌体的切离可作为调控开关,通过控制宿主tmRNA的功能来应对环境温度的变化,是新颖的适冷机制(图一)。
同时,王晓雪等受Drug Resistance Updates杂志的邀请,发表评述文章“Cryptic prophages as targets for drug development(2016, doi:10.1016/j.drup.2016.06.001)”,阐述了隐匿型原噬菌体如何作为相对永久的基因库参与宿主生理与代谢过程。特别关注原噬菌体上常携带的毒素-抗毒素系统,指出隐匿性原噬菌体是非常具有药物开发前景的靶点。
据介绍,环境温度的变化是自然界最常见的环境压力因子。环境微生物可通过调控转录、翻译过程以及改变细胞膜的结构来适应低温环境,而基因组的变化是否参与适冷过程并不清楚。论文采用的环境模式菌株Shewanella oneidensis MR-1分离于奥奈达湖泊(温度常年在0℃~25℃),是典型的耐冷菌。通过在模拟低温条件,结合全基因组深度重测序的方法,首次发现MR-1的基因组中存在新的原噬菌体CP4So,并且在低温条件下,原噬菌体的切离率能提高约10,000倍。分析发现原噬菌体CP4So的切离不仅造成其携带的36 kb片段的遗传信息的丢失,并且导致宿主整合位点附近的tmRNA的基因功能发生破坏。而原噬菌体发生切离的缺失株则在群体水平促进细菌生物被膜的形成,显著增强细菌在低温条件的存活能力。在对低温发生切离的机制研究中发现,原噬菌体上携带的剪切酶,具有直接诱导原噬菌体CP4So切离的活性;而宿主的转录调控因子H-NS能够结合在切离酶的启动子,抑制原噬菌体的切离。低温条件下,宿主胞内H-NS转录水平下降,从而解除对剪切酶的抑制,导致原噬菌体发生切离。
细菌的基因组富含原噬菌体片段(可高达30%),一度被认为是“冗余”片段。王晓雪等的前期研究工作中发现原噬菌体在大肠杆菌的生物被膜和宿主应激反应中扮演着重要的角色( The ISME Journal 2009; Nature Communications 2010; Scientific Reports 2015),在环境耐冷菌中的这项工作不仅证实了原噬菌体携带的基因直接参加宿主的胁迫反应,也证实原噬菌体的切离可作为调控开关,增强宿主的环境适应性。
该成果得到了国家自然科学基金和973计划等项目的资助。
附件下载: