
氮杂蒽醌类海洋天然产物生物合成与酶催化机理研究获进展
近日,中国科学院南海海洋研究所张长生研究员团队和厦门大学王斌举教授团队合作在氮杂蒽醌类海洋多环天然产物Deoxynybomycin(DNM)和Nybomycin(NM)生物合成与酶反应机制研究方面取得新进展,相关成果 “Deciphering Deoxynybomycin Biosynthesis Reveals Fe(II)/α-Ketoglutarate Dependent DioxygenaseCatalyzed Oxazoline Ring Formation and Decomposition”在线发表于Journal of the American Chemical Society (《美国化学会志》)。博士后刘凯、张锦岩(厦门大学),博士张光涛为共同第一作者,张长生、王斌举与张光涛为共同通讯作者。
恶唑啉是天然药物中的重要活性基团,在有机合成小分子活性化物结构衍生和修饰中有着广泛应用。2-恶唑啉环是自然界中常见的结构形式,其在非核糖体肽、核糖体肽和苯并恶唑类天然产物中的生物合成途径已经阐明。抗生素DNM和NM是自然界中罕见的含有4-恶唑啉基团的氮杂蒽醌类化合物。DNM具有显著抗革兰氏阳性菌活性,也是开发抗革兰氏阴性菌的药物先导化合物,其作用机制是与DNA Ⅱ型拓扑异构酶靶向结合,阻碍细菌DNA合成而发挥抗菌作用。DNM中的4-恶唑啉环是关键药效团,但其生物合成机制一直是未解之谜,限制了对这类活性氮杂蒽醌天然产物的深度挖掘和开发利用。
研究团队早期从南海深海沉积物来源的假诺卡氏菌(Pseudonocardia antitumoralis SCSIO 01299,张偲院士和田新朋研究员提供)分离发现了氮杂蒽醌类多环天然产物脱氧苯醌(Deoxynyboquinone,DNQ)(Mar Drugs, 2011,9:1428-1439)。近期,与澳门大学副教授余华合作揭示了DNQ的抗炎活性靶点与作用机理,发现DNQ可靶向烷基化修饰信号通路(Keap1-Nrf2-ARE)中Keap1上的关键位点Cys489,促使Keap1泛素化,并释放Nrf2进入细胞核激活下游抗炎效应因子的表达,从而发挥显著的抗炎活性(J. Pharm. Anal. 2023, doi:10.1016/j.jpha.2023.07.009)。
DNM与DNQ拥有相似的三环氮杂蒽醌线性骨架结构,可能具有相同的生源途径。本研究基于生物信息学分析定位了菌株SCSIO 01299和Embleya hyaline NBRC 13850(DNM产生菌)基因组中DNQ(dnq)和DNM(dnm)的生物合成基因簇(图1),进一步通过体内遗传与体外生化实验,发现了二者生物合成途径中的共同中间体5(图2),阐明了甲基转移酶DnmS负责DNQ和DNM氮甲基化后修饰,两个同源的Fe(II)/α-KG依赖型双加氧酶DnmT和DnmU分别负责DNM中4-恶唑啉环的形成和C-12位的羟基化(图2)。
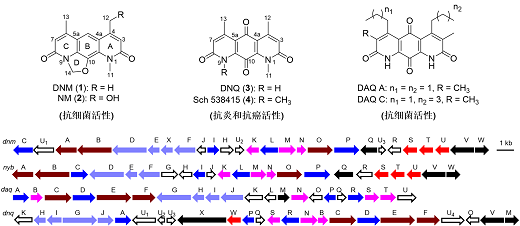
图1. 氮杂蒽醌类天然产物与其生物合成基因簇
在进行体外酶反应研究时,研究团队意外发现DnmT既能催化恶唑啉环的形成产生DNM,也能催化DNM中恶唑啉环的开环和脱N-甲基,最终形成中间体5,从而逆转DNM的生物合成。为阐释DnmT催化恶唑啉成环与开环的酶学基础,研究团队基于酶蛋白建模、点突变以及分子动力学(MD)模拟和量子力学/分子力学(QM/MM)多尺度计算化学等方法详细解析了DnmT催化成环、开环和脱甲基反应的新颖酶学机制,同时通过体外实验捕捉到反应中间体14,进一步佐证了该反应机理的合理性(图2)。
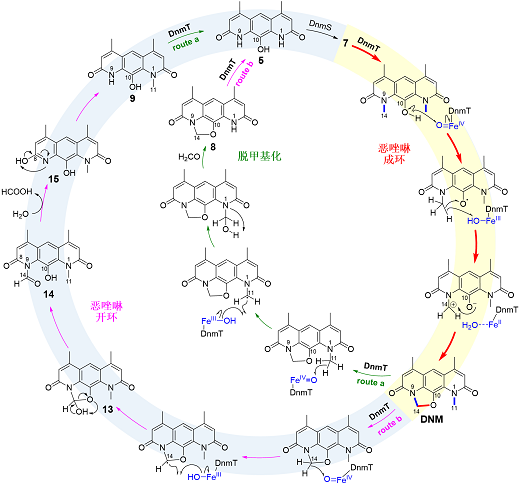
图2. Fe(II)/α-KG依赖型双加氧酶DnmT催化恶唑啉成环、开环和脱甲基化反应的机制
此外,研究团队还初步探索了DnmT催化多种反应的生物学意义。进一步发现,在野生菌株中,绝大部分DNM被分泌至胞外,而胞内含量较少;活性评估显示,DNM对革兰氏阳性菌的抑菌活性显著强于NM及其它中间体和副产物。由此,研究团队推测,DnmT催化恶唑啉成环产生DNM并释放到环境中,杀死自己的竞争者,提升自身的生存能力;而催化恶唑啉开环和脱甲基可能是为了控制胞内DNM的浓度,减少对细菌自身的毒性,这一假设有待进一步的深入研究证实。
综上所述,本研究解析了抗生素DNM中罕见4-恶唑啉药效团的合成途径,并利用酶学和计算化学等方法揭示了新颖多功能Fe(II)/α-KG依赖型双加氧酶DnmT催化恶唑啉成环、开环和脱甲基化的酶学机制,为Fe(II)/α-KG依赖型双加氧酶在天然产物生物合成中的功能多样性以及其可能的生物学意义提供了新见解,同时也为活性氮杂蒽醌类天然产物的基因组挖掘提供了重要科学依据。
上述研究工作得到了国家自然科学基金、广东省海洋经济发展(海洋六大产业)专项资金、海南省重大科技计划和中国科学院王宽诚率先人才计划“卢嘉锡国际团队项目”等的资助。
相关论文信息:1、Kai Liu#, Jinyan Zhang#, Guangtao Zhang#,*, Liping Zhang, Zhen Meng, Liang Ma, Wenjun Zhang, Weiliang Xiong, Yiguang Zhu, Binju Wang*, Changsheng Zhang*. Deciphering deoxynybomycin biosynthesis reveals Fe(II)/α-ketoglutarate-dependent dioxygenase-catalyzed oxazoline ring formation and decomposition. J. Am. Chem. Soc. 2023. https://doi.org/10.1021/jacs.3c11772
2、Ke-Gang Linghu, Tian Zhang, Guangtao Zhang, Peng Lv, Wenjun Zhang, Guanding Zhao, Shihang Xiong, Qiushuo Ma, Mingming Zhao, Meiwan Chen, Yuanjia Hu, Changsheng Zhang*, Hua Yu*. Small molecule deoxynyboquinone triggers alkylation and ubiquitination of Keap1 at Cys489 on Kelch domain for Nrf2 activation and inflammatory therapy. J. Pharm. Anal. 2023. doi: 10.1016/j.jpha.2023.07.009
附件下载: