
P450酶催化糖肽分子内苯酚偶联反应机制研究取得新进展
近日,南海海洋所张长生研究员团队和厦门大学王斌举教授团队合作在P450酶催化糖肽分子内苯酚偶联反应的机制研究方面取得新进展,相关成果“Discovery and Biosynthesis of Cihanmycins Reveal Cytochrome P450-Catalyzed Intramolecular C−O Phenol Coupling Reactions”发表于Journal of the American Chemical Society(《美国化学会志》)。南海海洋所博士方春艳、副研究员张丽萍和厦门大学博士生汪永超为论文共同第一作者,南海海洋所研究员张长生、研究员朱义广和厦门大学教授王斌举为共同通讯作者。
在化学生物学领域,细胞色素P450酶因其独特、多样的催化能力而备受瞩目。P450酶催化的分子内C−O和C−C苯酚偶联反应在天然产物生物合成中扮演着关键角色,广泛存在于糖肽类抗生素如万古霉素和替考拉宁中。虽然糖肽类抗生素中多个催化分子内苯酚偶联反应P450酶的功能和晶体结构相继被解析,但底物复合物结构的缺失导致该类反应的催化机制一直是未解之谜。
研究团队从放线菌Amycolatopsis cihanbeyliensis DSM 45679中发现了C−O连接的新型双环糖肽类化合物cihanmycins(CHMs,图1)。CHM A (1)的结构通过X-ray单晶衍射确定为双环糖肽,包含肉桂酰基团和两个稀有的D-阿拉伯呋喃糖。研究团队基于生物信息学分析和异源表达实验,在DSM 45679的基因组中定位了CHM的基因簇,并通过体内基因敲除和体外生化实验证实了3个P450酶的功能:Cih26负责肉桂酰基团的环氧化和羟化,Cih32负责三个氨基酸的羟化,Cih33及其同源蛋白DmlH和EpcH催化分子内C−O苯酚偶联反应形成CHM的双环骨架(图1)。
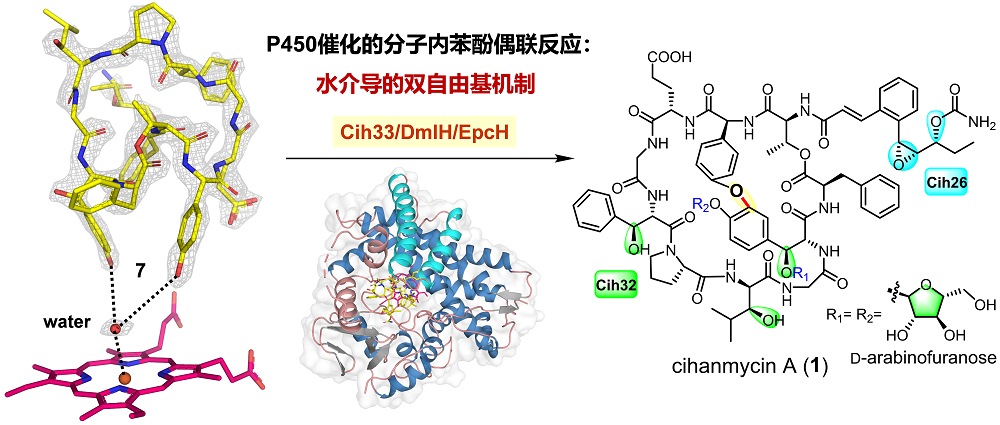
图1. CHM生物合成中3个P450酶的功能
为揭示Cih33及其同源蛋白催化C−O苯酚偶联反应的机制,研究团队开展了晶体学研究并解析了DmlH和DmlH−7复合物的晶体结构,首次揭开了分子内C−O苯酚偶联P450酶与大环肽结合模式的神秘面纱。同时,单环底物7的柔性结构使其NMR信号裂分复杂,难以解析结构,而DmlH−7的结构获取提供了通过复合物晶体鉴定小分子结构的经典案例。值得注意的是,底物7与DmlH的辅因子血红素(heme)平面之间有一个水分子,可能在苯酚偶联反应的攫氢过程中起关键作用。为验证这一推测,研究团队开展了分子动力学(MD)模拟和量子力学/分子力学(QM/MM)计算,揭示了DmlH催化分子内苯酚偶联反应由水介导的双自由基机制(图2),首次提出了水分子在双自由基苯酚偶联反应中的重要作用。
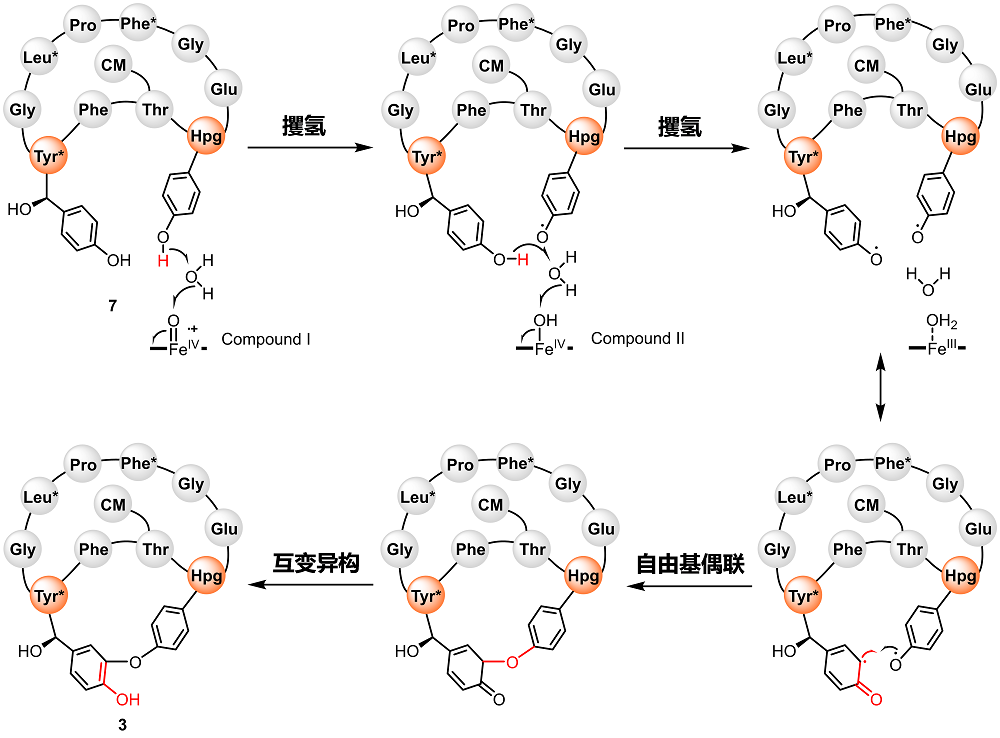
图2. 分子内苯酚偶联反应由水介导的双自由基机制(注:“*”为羟化氨基酸,“CM”为肉桂酰基团)
此外,基于生信分析,从数据库中挖掘到81个含有Cih33同源蛋白的肽类基因簇。对这些基因簇的P450酶进行系统发育分析,发现催化分子内苯酚偶联反应的Cih33/DmlH/EpcH和糖肽类抗生素的P450酶都聚集在同一分支,表明该分支中的其他P450酶可能具有相似的功能和机制,编码这些P450酶的基因簇有望产生新颖的双环肽类化合物。
综上所述,本研究证实了双环糖肽类化合物CHM生物合成中3个P450酶的功能,并利用酶学和计算化学等方法首次揭示了DmlH催化分子内苯酚偶联反应由水介导的双自由基机制,为深入理解P450酶催化的分子内苯酚偶联反应提供了新的视角,还为发现和开发更多新颖的双环肽类化合物奠定了研究基础,有望为抗生素研发提供更多物质基础。
以上研究工作得到了国家重点研发计划“合成生物学”重点专项、国家自然科学基金委重大项目、中国科学院王宽诚率先人才计划、广东省自然科学基金等项目资助。
相关论文信息:Chunyan Fang†,Liping Zhang†,Yongchao Wang†,Weiliang Xiong,Zier Yan,Wenjun Zhang,Qingbo Zhang,Binju Wang*,Yiguang Zhu*,and Changsheng Zhang*. Discovery and Biosynthesis of Cihanmycins Reveal Cytochrome P450-Catalyzed Intramolecular C−O Phenol Coupling Reactions. J. Am. Chem. Soc. 2024. DOI: 10.1021/jacs.4c02841.
文章链接:https://doi.org/10.1021/jacs.4c02841
附件下载: