近日,南海海洋所热带海洋生物资源与生态重点实验室鞠建华研究团队,在国际著名科学期刊《美国国家科学院院刊》(PNAS)上,发表了深海微生物来源的抗生素A201A研究的最新重要突破成果:Deciphering the sugar biosynthetic pathway and tailoring steps of nucleoside antibiotic A201A unveils a GDP-l-galactose mutase(PNAS, 2017, 114, 4948-4953)。论文报道了A201A糖基结构单元的生物合成和后修饰过程,发现并阐明了一个新颖的l-半乳糖吡喃-呋喃型变位酶MtdL。mtdL基因是一个有效的遗传标记,对指导发现自然界中包含l-呋喃半乳糖结构单元的活性天然产物具有重要指导意义。
自然界中的半乳糖(galactose, Gal)有d-和l-两种构型,以六元吡喃糖环(pyranose)型和五元呋喃型糖环(furanose)两种形式存在,因此具有四种异构体。哺乳动物中的d-Gal只有d-吡喃型(d-galactopyranose, d-Galp),而在细菌、真菌、原生动物以及一些病原生物中常以d-呋喃糖 (d-galactofuranose, d-Galf) 形式存在,并与毒力和致病性有着密切关系。与d-Gal的广泛存在相比,l-Gal作为维生素C合成的重要前体,在自然界中还较少被发现。目前呋喃型的l-Galf在小分子天然产物、动物细胞、植物组织、仔猪、蜂胶、灵芝多糖中被检测到,人们对催化l-Galf生物合成的酶并不清楚。
前期工作中,科研人员从深海来源的放线菌中分离得到核苷类抗生素A201A,通过基因组测序和基因敲除等手段鉴定了A201A的生物合成基因簇,并阐明一个负调控基因MtdA (Antimicrobial Agents and Chemotherapy, 2012, 56(1):110-114)的功能。抗生素A201A由氨基核苷、α-甲基桂皮酸、含不饱和双键的呋喃己糖和含α-d-鼠李糖四个结构单元组成(图1A)。A201A对G+菌和大多数厌氧性G-菌具显著的抗菌活性,通过作用于核糖体A位点抑制蛋白质的合成。
研究人员进一步对A201A糖基结构单元的生物合成和后修饰过程进行了剖析。首先通过在异源宿主Streptmyces lividans TK64中对基因簇进行异源表达确定了其边界(图1A),接着通过对18个生物合成基因进行系列阻断,突变株产生了10个新结构衍生物(图1D)。进一步结合同位素标记的前体喂养、体外酶促反应实验结果,发现糖基转移酶MtdG1对底物的识别具有一定的宽泛性,能够装配GDP-a-d-甘露糖和GDP-a-d-鼠李糖到A201A骨架上;MtdL在二价阳离子Mn2+或 Mg2+存在的情况下,能够可逆催化GDP-β-l-Galp转化成GDP-a-l-Galf,是自然界中首次发现的吡喃糖-呋喃糖基变位酶(图1C);通过对MtdL进行氨基酸定点突变确证Asp109、Asp111和Arg159是对其活性负责的关键氨基酸残基。
A201A生物合成的后修饰过程由四个甲基转移酶MtdM1、MtdM2、MtdM3和MtdM4以及一个脱氢酶MtdW参与:MtdM1 负责A201A中 3'-氨基-3'-脱氧腺苷结构单元的N, N-二甲基化; MtdM2和MtdM3分别负责A201A中α-d-鼠李糖结构单元OH-C-4'和 OH-C-3'的O-甲基化;MtdM4负责L-半乳呋喃糖结构单元中OH-C-5' 的O-甲基化;MtdW是一类新颖的脱氢氧化酶,负责L-半乳呋喃糖结构单元中C-4/C-5的脱饱和作用。四个甲基转移酶和脱氢酶具有严格的区域选择性和较为宽泛的底物识别性(图1D)。科研人员对采用生物合成技术获得的新结构衍生物进行了抗菌活性筛选,得到了药效相当但水溶性得到提高的药物先导化合物des-N,N-dimethyl-A201A。
课题组朱清华博士后和陈奇博士为论文共同第一作者,研究工作得到国家杰出青年科学基金、中科院战略先导海洋科技专项和广东省自然科学基金团队等项目资助。
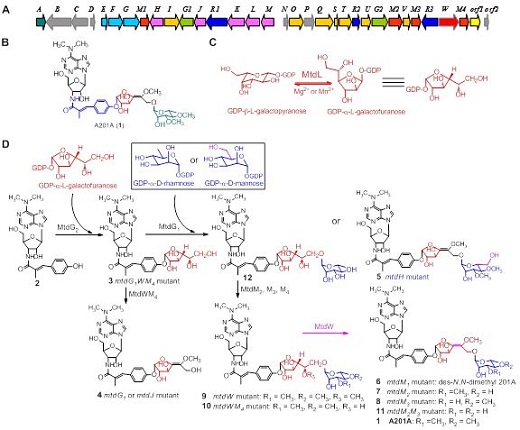
图1.(A)A201A的生物合成基因簇的组织结构;(B)A201A的化学结构;(C)变位酶MtdL催化GDP-吡喃半乳糖和GDP-呋喃半乳糖之间的可逆反应;(D)A201A的生物合成途径中糖的后修饰过程。

